IVERIC bio, Inc. (Nasdaq: ISEE) a annoncé aujourd’hui l’achèvement de l’analyse post-hoc visant à évaluer divers paramètres de croissance de l’atrophie géographique (AG) afin d’étudier le taux de progression de la maladie dans diverses zones de la fovéa chez un sous-groupe de patients de l’essai clinique de Phase 3 GATHER1 Zimura® (avacincaptad pegol) pour le traitement de l’AG.
Ce communiqué de presse contient des éléments multimédias. Voir le communiqué complet ici : https://www.businesswire.com/news/home/20220210005975/fr/
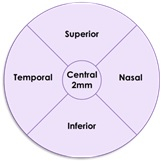
The accompanying schematic illustrates the five standardized regions (Graphic: Business Wire)
Dr Dhaval Desai, directeur du développement d’Iveric Bio: «En concordance avec les résultats globaux de GATHER1, la nouvelle analyse a permis d’observer une réduction de la croissance des lésions dans cinq zones standardisées entourant et incluant la zone fovéale centrale chez les patients recevant 2 mg de Zimura par rapport aux patients recevant un traitement placebo pendant une période de 18 mois. Nous pensons que la tendance à la réduction de la croissance de l’AG observée est cohérente avec l’histoire naturelle de la maladie et avec les résultats d’essais cliniques récents montrant que l’inhibition du complément est associée à une réduction plus importante de la croissance de l’AG chez les patients atteints d’AG non fovéale, dont on sait, d’après l’histoire naturelle, qu’elle progresse plus rapidement que l’AG impliquant la fovéa. Cette analyse confirme notre attente selon laquelle nous devrions constater une réduction de la croissance plus importante loin du centre fovéal, reflétant le modèle de croissance circonférentielle typique des patients atteints d’AG.»
Dr Pravin U. Dugel, président d’Iveric Bio: «L’atrophie géographique a un impact majeur sur la vision fonctionnelle qui peut altérer la qualité de vie et l’autonomie des personnes concernées. Nous pensons que les résultats de cette analyse exploratoire représentent une étape supplémentaire dans l’étude des capacités du Zimura de préserver la vision centrale en ralentissant la progression de l’AG.»
Les résultats de cette analyse de sous-groupe sont cohérents avec ceux de l’analyse primaire dans la population en intention de traiter. L’analyse post-hoc a évalué la croissance de l’AG dans cinq zones standardisées de la rétine chez des patients pour lesquels des images étaient disponibles à des moments pertinents (n = 47 dans le groupe Zimura 2 mg et n = 79 dans le groupe placebo). Les cinq zones comprenaient la zone fovéale centrale, composée d'un cercle de 2 mm de diamètre autour du point fovéal central et quatre quadrants, temporal, nasal, supérieur et inférieur dans un cercle concentrique de 8 mm de diamètre autour du point fovéal central. Le schéma ci-joint illustre les cinq zones normalisées.
Les graphiques montrent les résultats de l’analyse qui seront présentés aujourd’hui lors de la réunion «Angiogenesis, Exsudation, and Degeneration 2022» par le Dr Glenn J. Jaffe, directeur, Duke Reading Center Chief, Retina Division, Duke Eye Center, Robert Machemer Professor of Ophthalmology.
Iveric Bio mettra à disposition la série complète des diapositives de la présentation sur le site Web de la société à l’adresse https://investors.ivericbio.com/events-and-presentation au début des présentations à 11h00, heure de l’Est.
À propos de GATHER1 et GATHER2
Iveric Bio avait précédemment annoncé la mise en évidence par GATHER1 que le Zimura (avacincaptad pegol) avait atteint son paramètre d’efficacité primaire pré-spécifié avec une pertinence statistique dans l’essai clinique de Phase 3. Les événements oculaires indésirables les plus fréquemment rapportés avec le Zimura dans le cadre de cet essai étaient liés à la procédure d’injection. La Société estime que les premières données de GATHER2, un deuxième essai clinique de Phase 3 du Zimura pour le traitement de l’AG, seront disponibles dans le courant du second semestre 2022, environ un an après l’inscription du dernier patient dans l’essai, plus le temps nécessaire pour verrouiller la base de données et l’analyse. Si les résultats à 12 mois de GATHER2 sont positifs, la Société prévoit de déposer, avec les résultats de GATHER1 et de GATHER2, des demandes d’autorisation de commercialisation du Zimura pour le traitement de l’AG auprès de la Food and Drug Administration des États-Unis et de l’Agence européenne des médicaments. Il n’existe pas de traitements approuvés par la FDA américaine ou l’Agence européenne des médicaments disponibles pour les patients atteints d’AG.
À propos du Zimura
Le Zimura (avacincaptad pegol) est un médicament expérimental dont l’utilisation n’a encore été approuvée nulle part dans le monde. Le Zimura est conçu pour cibler et inhiber le clivage de la protéine C5 du complément et la formation de ses fragments C5a et C5b en aval. En inhibant la formation de ces fragments, on pense que le Zimura diminue ou ralentit l’inflammation chronique et la mort cellulaire associées au processus du vieillissement rétinien en réduisant la formation du complexe d’attaque membranaire (MAC) et l’activité de l’inflammasome, ce qui évite ou ralentit ainsi potentiellement la dégénérescence de l’épithélium pigmentaire rétinien. Ce mécanisme potentiel est la raison d’être du Zimura en tant que traitement potentiel de l’atrophie géographique.
À propos d’Iveric Bio
Iveric Bio est une société scientifique biopharmaceutique qui se concentre sur la découverte et le développement de nouveaux traitements pour les maladies de la rétine pour lesquelles il existe d’importants besoins médicaux non satisfaits. La Société s’engage à avoir un impact positif sur la vie des patients en proposant des traitements de haute qualité, sûrs et efficaces conçus pour traiter les maladies de la rétine, notamment les stades précoces de la dégénérescence maculaire liée à l’âge. Pour plus d’informations sur Iveric Bio, visiter le site www.ivericbio.com.
Énoncés prospectifs
Toute déclaration contenue dans le présent ce communiqué de presse ou faite dans le cadre de la présentation annoncée concernant les attentes, les plans et perspectives futures d’Iveric Bio sont des énoncés prospectifs au sens des dispositions du Private Securities Litigation Reform Act de 1995. Les énoncés prospectifs incluent toutes les déclarations sur la stratégie de la Société, les opérations futures et les attentes, plans et perspectives de la Société, ainsi que toute autre déclaration contenant les mots «anticiper», «croire», «estimer», «attendre», «avoir l’intention», «objectif», «peut», «pourrait», «planifier», «prédire», «projeter», «rechercher», «cibler», «potentiel», «fera», «ferait», «pourrait», «devrait», «continuer», et autres expressions similaires. Dans le présent communiqué de presse, les énoncés prospectifs de la Société incluent les déclarations relatives à ses attentes quant au développement du Zimura et à la stratégie réglementaire liée à celui-ci, ses plans concernant des indications supplémentaires, telles que la DMLA intermédiaire, que la Société pourrait mettre en œuvre aux fins du développement du Zimura, l’utilité potentielle du Zimura et la pertinence clinique des résultats des essais cliniques. Ces énoncés prospectifs impliquent des risques et des incertitudes substantiels susceptibles d’entraîner une différence considérable entre les programmes de développement, les résultats futurs, les performances ou les réalisations de la Société et ceux exprimés ou sous-entendus par les énoncés prospectifs. Ces risques et incertitudes comprennent, entre autres, ceux liés à l’avancement et au succès des programmes de recherche et développement et des essais cliniques, et d’autres facteurs mentionnés à la rubrique «Risk Factors» contenue dans les rapports trimestriels et annuels déposés par la Société auprès de la Securities and Exchange Commission. Tout énoncé prospectif exprime les opinions de la Société uniquement à la date du présent communiqué de presse. La Société reconnaît que des événements et développements ultérieurs pourraient modifier ses opinions. Bien que la Société puisse décider de mettre à jour ces énoncés prospectifs à un moment donné dans le futur, la Société décline expressément toute obligation de le faire, sauf si la loi l'exige.
ISEE-G
Le texte du communiqué issu d’une traduction ne doit d’aucune manière être considéré comme officiel. La seule version du communiqué qui fasse foi est celle du communiqué dans sa langue d’origine. La traduction devra toujours être confrontée au texte source, qui fera jurisprudence.
Consultez la version source sur businesswire.com : https://www.businesswire.com/news/home/20220210005975/fr/

